越境ECにおけるFDA規制の重要性
米国市場への越境ECビジネスを展開する際、FDA(食品医薬品局)の規制への理解と遵守は避けて通れない課題です。規制違反が発覚した場合、事業停止や製品の差し押さえ、さらには刑事訴追に至るケースも存在します。本記事では、実際に起きた法的トラブル事例を通じて、どのような違反がどれほどのコストを招くのかを明らかにし、同様のリスクを回避するための実践的な予防策を提示します。
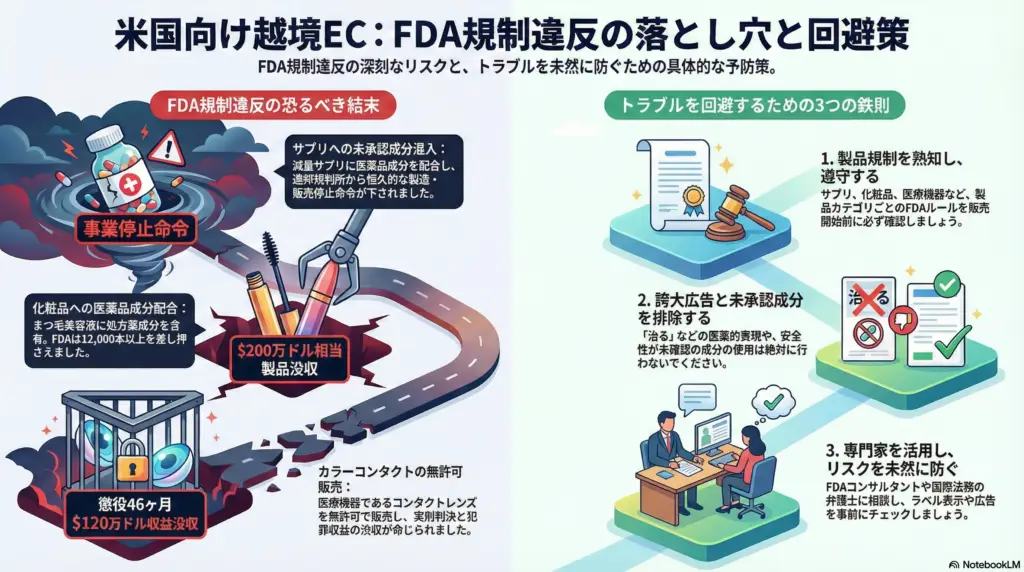
事例1:未承認医薬品成分混入による営業停止
違反の概要
ニューヨークを拠点とするBethel Nutritional Consulting社は、減量用サプリメント「Bethel 30」などの製品に、FDA未承認の医薬品成分を秘密裏に配合していました。具体的には、2010年に安全性問題で市場から撤退したシブトラミンや、処方薬であるロルカセリンといった成分を含有しながら、製品ラベルには一切表示していませんでした。
これらの隠し成分は、摂取者に心臓発作や脳卒中などの重大な健康被害をもたらすリスクがあり、FDAにとって看過できない問題となりました。
FDAによる法的措置
2014年、FDAのサンプル検査で違法成分が検出されたことを受け、同社は自主回収を実施しました。しかし事態はそこで収束せず、2015年には米司法省がFDAに代わって訴訟を提起。連邦裁判所で恒久的差止命令の同意判決が承認され、同社はFDAが法令遵守を認めるまで、サプリメントの製造・販売を全面停止することが義務付けられました。
企業が負担したコスト
直接的な罰金に関する報道はありませんが、違法製品の回収・廃棄コスト、営業停止による逸失利益、そして当局対応のためのコンサルティング費用が発生しました。中小規模の健康食品メーカーでも、FDA対応には数万から数十万ドルの法務費用がかかるとされており、差止め訴訟への対応費用はそれを大きく上回ったと推測されます。
企業の対応と結果
Bethel社は同意判決という形で当局の要求を全面的に受け入れ、GMP(適正製造基準)の改善やラベル表示の是正など抜本的な対応を求められました。違反製品は市場から完全に排除され、事業再開にはFDAの確認が必要となったため、売上喪失とブランド信用の失墜は避けられませんでした。
この事例から学ぶ教訓
減量や健康効果を謳うサプリメント分野では、効果を高めるために医薬品成分を密かに混入させる事例が後を絶ちません。しかしFDAの検査体制は年々強化されており、違法成分が発覚すれば販売差し止めや製品没収といった厳しい措置が取られます。
越境EC事業者は、米国で販売する製品について成分と表示の法令順守を徹底する必要があります。特に減量や疾病予防など医療効果を標榜する表現は、FDA管轄下の「医薬品」扱いとなるため絶対に避けるべきです。サプリメントはあくまで栄養補助食品としての範囲内でマーケティングし、製造段階から品質管理を徹底することで違法混入のリスクを防がなければなりません。
事例2:化粧品への医薬品成分配合による差し押さえ
違反の概要
Jan Marini社の「Age Intervention Eyelash」は、まつ毛を伸ばす美容液として人気を博していましたが、実は処方医薬品の有効成分であるビマトプロストを含んでいました。ビマトプロストは本来緑内障治療薬の成分ですが、同社はまつ毛の育毛効果があるとしてこれを配合し、「まつ毛が増える」と宣伝していました。
化粧品でありながら人体の機能に影響を与える成分を含む製品は、FDAの定義では未承認医薬品と見なされます。
FDAによる法的措置
2007年11月、FDAは連邦保安官を通じてこのまつ毛美容液12,682本(市価約200万ドル相当)を一斉に差し押さえ・没収しました。FDA発表によれば、本製品は「添加物による有害な化粧品」に該当し、高眼圧症の患者などが使用すると視神経障害のリスクがあると警告されました。
同社は既に問題成分を除いた新配合品に切り替えていましたが、FDAは見せしめのためあえて差し押さえを行い、プレスリリースで公表しました。
企業が負担したコスト
差し押さえられた在庫約200万ドル相当はそのまま廃棄処分となり、同社にとって大きな損失となりました。また、FDAとの応酬や是正対応のために法務・コンサルタント費用が発生しています。社長によれば、販売停止から差し押さえに至るまで当局との交渉に相当のリソースを割いたものの解決に至らず、在庫ロスとブランドイメージ低下という痛手を被ったとのことです。
刑事訴追はされなかったものの、違法物質を含む商品を販売した責任から、将来的な民事訴訟リスク(消費者からの損害賠償請求)も抱えることになりました。
企業の対応と結果
Jan Marini社はFDAの指摘後、該当製品を処方薬成分抜きの処方に改良し、薬機法に抵触するマーケティング表現も撤回しました。同社は「自発的に廃棄すると申し出ていたのに、FDAは敢えて強制押収に踏み切った」とコメントしていますが、最終的には当局と争うことなく従い、問題成分を除去した新製品で販売を再開しました。
FDAは「米国民を未承認医薬品から守る責務」を強調し、この措置を通じて業界全体に警告を発しました。
この事例から学ぶ教訓
効き目の強い化粧品には要注意です。美容目的の化粧品に医薬品成分を入れたり、「治療」「成長促進」といった効果効能を標榜したりすると、それは法律上は医薬品扱いとなります。FDA承認を経ずにそのような製品を売れば、数百万ドル相当の在庫を差し押さえられ事業停止に追い込まれる可能性があります。
特に越境ECで米国に化粧品を輸出する場合、ラベル表示(成分表示や使用上の注意)や広告表現がFDA規則に反していないか十分確認する必要があります。「皮膚の再生」や「シミを治療」などの文言は、FDAにより未承認医薬品の効能表示と見なされる典型例です。
化粧品はFDAの事前承認制度こそありませんが、問題発生時には厳しい事後制裁があることを認識し、合法かつ安全な製品づくりと誠実な表示を徹底すべきです。
事例3:カラーコンタクトレンズの違法輸入販売と刑事罰
違反の概要
Candy Color LensesのオーナーであるDmitriy Melnik被告は、日本や韓国、中国など海外製のカラーコンタクトレンズを米国内の消費者向けに無許可で販売し、大規模に利益を上げていました。
カラーコンタクトはおしゃれ用途であっても、目に装用する医療機器としてFDAの事前承認や処方箋が必要です。しかし同被告はそうした手続きを一切取らず、アジアのサプライヤーから偽ブランド品や未承認品を大量輸入していました。中には大手メーカーの正規品を装った商標偽造コンタクトも含まれ、また一部は細菌に汚染された粗悪品でした。
FDAによる法的措置
FDAの刑事捜査部門が主導する「Operation Double Vision」と呼ばれる捜査の一環で摘発され、Melnik被告は連邦起訴されました。2016年に有罪答弁を行い、2017年1月に連邦裁判所は懲役46か月(約4年)の実刑判決を言い渡しました。
罪状は「偽ブランド品取引の共謀」および「マーキング不備医療機器の州際流通」で、有罪に伴い犯罪収益120万ドルの没収と被害額20万ドルの賠償金も科されました。さらに捜査過程で押収された在庫や資産も没収対象となりました。
企業が負担したコスト
このケースでは刑事弁護費用それ自体も莫大でしたが、公判終了時点で被告資産の大半は没収されており、事業から得た利益はほぼ失われました。また約4年の服役期間中は当然ビジネス継続も不可能です。
違法行為により築いた収益は罰金・追徴金や被害補償として回収される上、弁護士費用も自己負担となるため、経済的破綻は免れませんでした。刑事事件化するとビジネス上・財務上のダメージは計り知れないものとなります。
企業の対応と結果
被告は捜査当局に協力し、有罪を認めることで比較的短期間で事件は決着しましたが、それでも約4年の実刑が科されました。また120万ドル以上の売上没収と高額賠償により経済的にも大きな代償を支払いました。
この事件は米国で過去最大規模の違法カラーコンタクト摘発例となり、FDA・ICE(移民関税執行局)・郵便検査局など複数の連邦機関が合同で違法商品の根絶にあたりました。結果としてCandy Color Lensesは閉鎖され、関連する違法コンタクト業者に対する抑止力となっています。
この事例から学ぶ教訓
医療機器は無許可で売れば犯罪という原則を決して忘れてはいけません。カラーコンタクトのように一見ファッション商品でも、米国では連邦法で厳しく規制された医療機器です。海外からネット通販で気軽に売っても、FDAと税関の監視下にあり、発見されれば即輸入差し止めや刑事捜査につながります。
越境EC事業者は、自社が扱う製品が医療機器に該当しないか事前によく確認し、該当する場合はFDA登録・認可取得や米国販売代理人の設置、そしてエンドユーザーには医師の処方箋を要求するなど、法令に沿った販売方法を取らねばなりません。
万一訴訟になれば、勝っても数百万ドル規模の弁護士費用を費やすリスクがあるため、違法行為に手を染めないことはもちろん、自社製品の流通経路にも目を配り、不正があれば早期に対処・是正することが肝要です。
FDA違反を回避するための7つの予防策
1. 製品ごとのFDA規制を熟知し遵守する
米国に輸出する製品が食品・健康食品・化粧品・医療機器のいずれであれ、それぞれに適用されるFDAルールを事前に確認しましょう。例えばサプリメントなら医薬的効能の表示禁止や必須表示事項の順守、化粧品なら配合禁止成分やラベル要件の確認、医療機器ならクラス分類に応じたFDA登録や510(k)承認取得などが欠かせません。
事前準備にコストと時間をかけることで、違反による販売停止や廃業のリスクを大幅に下げられます。
2. 誇大広告や未承認成分を排除する
「治る」「劇的な効果」等の表現は規制当局の標的になります。また各種事例が示す通り、痩身や強壮効果を謳う海外製品に未承認薬物が混入していると、FDA検査で発覚し即時輸入禁止になります。
合法かつ安全な成分のみを使用し、根拠のない効能主張はしないことが基本です。
3. 初動対応の徹底
万一FDAから警告書や是正勧告を受けた場合、15営業日以内という短い回答期限内に真摯に対応策を提出しましょう。自主回収や販売一時停止など必要な措置は迅速に行い、当局に誠意を示すことが重要です。
対応が遅れたり不十分だったりすると、警告が差し押さえや訴訟など強制措置に発展し、事態が深刻化します。
4. 保険の活用
企業規模にかかわらず、製造物責任保険や製品リコール保険、役員賠償責任保険などの加入を検討してください。特に米国での訴訟リスクに備えた海外PL保険は有効です。
保険に入っていても訴訟そのものを防げるわけではありませんが、賠償金や訴訟費用(弁護士費用)を補償してくれるため、万一の法的トラブル発生時に企業のダメージを深刻化させずに済みます。
5. 専門家への相談
越境ECに詳しい国際法務の専門弁護士やFDAコンサルタントを活用しましょう。販売国ごとの言語や規制に適合した利用規約・プライバシーポリシー作成、ラベル表示チェックなどは専門家の助言でリスクを軽減できます。
違反の疑いがある場合も自己判断せず、早めに専門家に相談することで違法性を事前に除去し、当局との摩擦を未然に防げます。
6. 当局の動向モニタリング
FDAや米国税関が発する輸入警告(Import Alert)やリコール情報を定期的にチェックしましょう。自社と類似の製品カテゴリーで輸入拒否事例が出ていないか把握すれば、自社製品に潜む問題にも気付きやすくなります。
規制強化の兆候(例:特定成分への警戒)があれば、早めに代替成分への切替え等の対応を検討すべきです。
7. リスク覚悟と費用計画
最悪の場合、FDA係争では法務費用が青天井になり得ます。実際、ある医療機器メーカーはFDAからの訴訟を争って勝訴しましたが、その間に300万ドル以上の弁護士費用を費やしたケースも存在します。訴訟で勝っても費用は回収できず、経営資源も奪われます。
越境ECに乗り出す以上、「万一訴訟になれば数百万ドル規模のコスト」という覚悟を持ちつつ、違反しないことでそのリスク自体を回避する戦略を取ることが肝要です。
まとめ:規制遵守こそが持続可能な越境ECの鍵
本記事で紹介した3つの事例は、FDA規制を軽視した越境ECがいかに危険であるかを明確に示しています。短期的な利益を追求して違法な抜け道を使えば、結局は何倍もの法務コスト・損害賠償・罰金を支払う羽目になります。
国際ビジネスにおいては、各国の規制遵守が信頼構築の前提条件です。「他社もやっているから大丈夫」ではなく、「最悪の場合に何が起こるか」を常に念頭に置いてビジネス判断することが、安全かつ持続的な越境EC展開の鍵と言えるでしょう。
違反による莫大な損失を避けるため、事前の規制確認と専門家への相談に投資することが、長期的には最もコスト効率の高い選択となります。
コメント