急拡大する米国サプリメント市場と規制見直しの背景
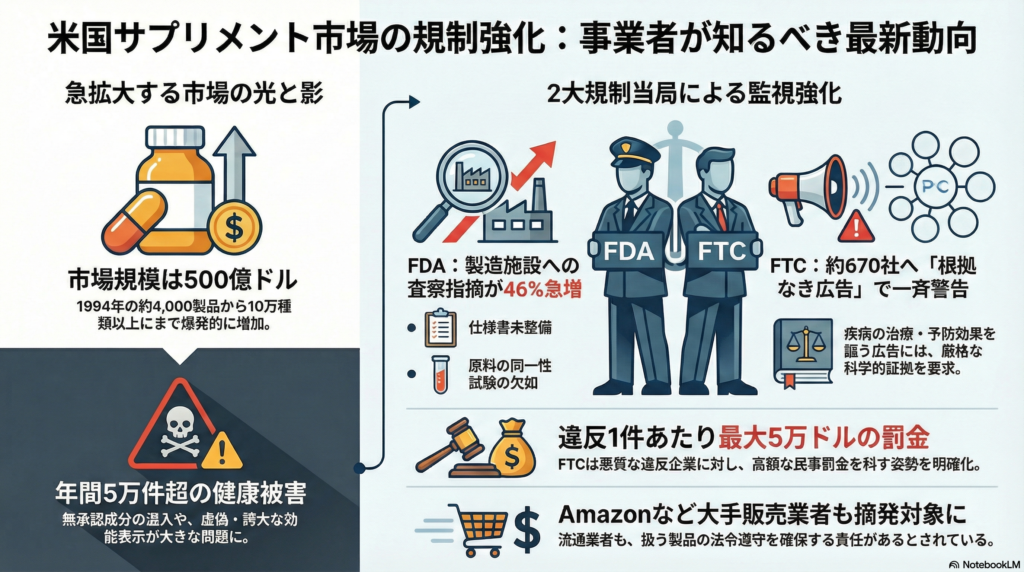
米国のサプリメント市場は近年、爆発的な成長を遂げています。1994年時点で約4,000種類だった製品数は、2020年代には10万種類以上にまで膨れ上がり、年間売上は約500億ドル規模に達しました。利用者の約75%が何らかのサプリメントを日常的に摂取する中、市場拡大の陰で深刻な問題が顕在化しています。
無承認成分の混入、虚偽・誇大な効能表示、そして未報告の健康被害が推定年5万件以上に上るとされる安全性問題です。こうした状況を受け、FDA(米食品医薬品局)とFTC(米連邦取引委員会)を中心に、2023年から2024年にかけて規制強化の動きが加速しました。本記事では、最新の法規制動向から具体的な執行事例、企業が取るべき対策まで、米国市場でサプリメント事業を展開する上で不可欠な情報を包括的に解説します。
法制度とガイドラインの刷新:透明性向上への取り組み
製品登録義務化法案の動き
1994年に制定された「栄養補助食品健康教育法(DSHEA)」は、米国サプリメント規制の基本枠組みを提供してきましたが、市場環境の変化に対応した近代化が求められています。2022年以降、連邦議会では「栄養補助食品リスティング法案」が複数回提出されました。
この法案は、全製造業者に対して製品名、全成分、ラベル情報、表示効能などをFDAに届け出させ、公開データベース化する内容です。主要業界団体も支持を表明しており、FDAが市場に出回る製品情報を十分に把握できない現状を改善する狙いがあります。2023年時点で法案は未成立ですが、透明性向上と安全確保の観点から、今後も立法措置が模索される見通しです。
FTCによる広告ガイダンスの全面改訂
特筆すべきは、FTCが25年ぶりに広告表示の指針を全面改訂したことです。2023年初頭に公表された「ヘルス製品コンプライアンスガイダンス」は、1998年の旧ガイドを刷新し、サプリメントを含む健康関連製品全般の広告表示に適用されます。
同ガイダンスは「広告は真実で誤解を招かず、合理的根拠(科学的証拠)に裏付けられていなければならない」というFTC法の基本原則を強調し、健康効果や安全性については「確かな科学的証拠」による事前の実証を義務付けました。疾病の治療・予防効果をうたう場合は、厳格な臨床試験データ、原則としてランダム化比較試験が必要である点も明記されています。
さらに、近年のSNSやインフルエンサーを用いた宣伝形態も踏まえ、広告には従来型メディアに限らずSNS投稿、製品レビュー、ラベル上の表示まで広く含まれることが説明されています。
FDAによる新規成分申請指針の整備
FDAも規制の実効性を高めるため、新規成分申請(NDI:New Dietary Ingredient)に関する指針を整備しました。2023年3月にNDI届出手順・審査期間に関する最終ガイダンスを発出し、企業とFDAの事前相談の流れや提出書類の標準化を図っています。
2024年4月には「NDIマスターファイル制度」に関する追加ガイダンスも公表されました。これらは未承認の新規成分が無届けで市場投入される問題への対策であり、FDAは業界に対して過去の未届出成分の申請や安全性データ提出を促す対応を取っています。
FDAによる執行強化:組織再編と査察の厳格化
組織体制の抜本的見直し
FDAは2024年10月、食品安全センター(CFSAN)を再編し、新たに「ヒト食品プログラム(Human Foods Program)」を設置しました。その下に「食品化学安全・栄養補助食品・イノベーション局」を創設し、サプリメントの成分安全評価や革新的素材の規制を一元的かつ総合的に所管する体制を整えました。
専任のジェームズ・ジョーンズ副長官(ヒト食品担当)が全権を掌握する仕組みとなり、サプリメント規制が食品化学安全の文脈で厳格化されることが期待されています。
査察・摘発件数の大幅増加
執行面では、FDAの査察指摘事項が顕著に増加しています。2023年から2024年にかけて、食品分野全体のFDA査察指摘事項が減少傾向にある中、サプリメント製造施設に限ると指摘事項数が46%増加しました(2023年1,083件→2024年1,578件)。
特に多い違反内容は「製品の仕様書未整備」で、完成品の同一性・純度・強度・組成を規定していないケースが2023年・2024年とも指摘事項の第1位でした。また「原料ごとの同一性試験の欠如」も2024年に新たな重点指摘事項となり(2023年は0件だったのが2024年は66件発生)、FDAが各構成成分の真正性確認に注力し始めたことを示しています。
違法成分への厳格な取り締まり
FDAは無承認成分や医薬品成分を含むサプリメントを発見次第、警告書発行や回収措置を講じています。代表的な事例として、2023年11月に抗うつ薬成分チアネプチン(俗称”ガソリンスタンドのヘロイン”)を含む違法サプリ「Neptune’s Fix」について消費者に使用中止を警告し、2024年1月には小売業者に販売停止を要請しました。
この製品は重篤な副作用(けいれん、意識喪失、死亡例)を引き起こし、自主回収に追い込まれました。チアネプチンはFDAにより「食品にもサプリにも認められない有害物質」と位置付けられており、市場流通は違法です。
同様に、抗不安成分フェニブット(ロシアで医薬品)についても、FDAは2019年から「サプリメント成分定義を満たさない違法成分」と公式見解を示し、継続的に市場監視を行っています。
2025年末には、鎮痛効果をうたうサプリ「Silintan」に処方薬NSAIDsのメロキシカムが含有されていたため全ロット回収となりました。FDAは「メロキシカム含有製品は深刻な心血管リスク(血栓、心筋梗塞、脳卒中)を伴うためサプリとして合法販売は不可」と警告し、販売者に対して過去の違反歴も含めて厳重に通告しています。
大手流通業者への警告も
注目すべきは、AmazonやCVS、Walgreensといった大手販売業者も摘発対象となったことです。これらの企業は、自社プラットフォームで違法サプリ(未承認ドラッグ成分含有製品や未承認医薬部外品など)を販売した件で2022~2023年にFDAから警告書を受領しました。
FDAは「流通事業者であっても扱う製品の法令遵守を確保する責任がある」との立場を明確にし、知名度の高い企業への措置を通じて業界全体へのけん制を図っています。
FTCによる広告規制の強化と大規模警告
670社への一斉通知
2023年4月、FTCは医薬品・ホメオパシー・サプリ・機能性食品のマーケティング企業約670社に対し、「根拠なき製品効果表示」に関する警告通知を一斉送付しました。
この通知書では「広告主は製品効果に関する合理的根拠を有しなければならない」という原則を改めて喚起し、特に重大疾病(がんや心疾患など)を治療・予防できると謳う場合には「厳格な科学的試験(少なくとも1件の適切に管理された人体臨床試験)」による実証が必要とされています。
FTCは「悪質な違反者には違反1件当たり最大5万ドル(具体的には50,120ドル)の民事罰金を適用し得る」と明記し、事前に通知を受けた後も違法表示を続ければ高額罰金を科すという姿勢を示しました。
具体的な執行事例
FTCは実際に多数の企業に対して制裁措置を取っています。2023年2月、関節痛緩和サプリをRCT(無作為比較試験)なしに「軟骨再生で痛み軽減」と広告していたメーカーZyCal社に対し、不実表示の恒久禁止命令で合意しました。
悪質な再犯業者に対しては、業界からの排除措置も辞さない姿勢です。2022年3月には、心臓病治療や糖尿病神経障害改善を謳った複数のサプリを販売していたテキサス拠点の業者2社とオーナー個人に対し、「将来的に一切のサプリ製造・販売を禁止」する厳格な同意命令を課しました。この命令では、違反時に1件当たり最大約46,517ドルの民事罰が科される可能性も明記されています。
企業が遵守すべき重要ポイント
製造工程の適正管理(cGMP遵守)
21 CFR Part 111に定められた現在の適正製造基準を厳格に守り、各製品ごとに完成品の品質規格(成分の同一性・純度・含有量・組成)を文書化して設定することが必要です。
原材料についても受入時の同一性試験を実施し、表示ラベルどおりの成分が用いられているか検証します。試験手法は成分に応じてHPLC、質量分析、DNA分析等の信頼性ある分析法を導入し、結果を記録・保管することが求められます。品質管理記録やSOP(標準作業手順)を整備し、社内監査で継続的に見直すなど、FDA査察で指摘されがちな不足事項を事前に是正する取り組みが不可欠です。
原材料・成分の合法性確認
使用する成分が米国法で使用許可された「食品/サプリ成分」かを事前に確認する必要があります。具体的には、1994年以降に市場導入された新規成分についてはFDAへのNDI通知要否を判定し、必要なら上市前にNDI申請を行うことが必須です。
医薬品成分やその類似物質、指定有害物質が紛れ込まないようサプライヤーを監査し、原料の分析証明書(CoA)を取得・検証することも重要です。FDAの公開する「サプリメント成分ディレクトリ」を活用し、過去にFDAが警告を発した成分(チアネプチン、フェニブット、DMAA/DMHA、未承認医薬品成分など)をチェックすることも有効です。
表示・ラベルの適法性
製品ラベルにはFDAの表示規則を遵守した「サプリメントファクト欄」(成分名・含有量・%DV等)や「アレルゲン表示」を適切に記載しなければなりません。2021年までに段階的に施行された新栄養表示規則にもとづき、最新のラベル様式へ移行していることを確認します。
構造・機能表示を行う場合、DSHEA免責文言(「本製品はFDAによる評価を受けておらず、疾病の診断・治療・予防を目的としない」旨の文言)を忘れずに記載する必要があります。現行規則ではこの免責文言は関連表示のある各ラベル面ごとに表示することが求められていますが、FDAは2025年12月に表示箇所要件を緩和する規則改正を検討中です。
広告・マーケティング上の留意点
サプリメントの効果効能を訴求する際はFDAとFTCの双方の規制に注意が必要です。基本的に製品パッケージや添付文書上の表現はFDA管轄、WebサイトやSNSを含む広告宣伝はFTC管轄となります。
疾病の治療・予防効果を標榜することは違法であり、あくまで一般的な健康維持や機能のサポート止まりの表現にとどめる必要があります。たとえ許容される機能性表示であっても、事前にその主張を裏付けるエビデンスを保持しておくことが必須です。
広告に第三者の推薦やユーザーレビューを利用する場合、金銭や利益提供による関係性(マテリアルコネクション)の開示も義務です。FTCは2023年にガイドラインを改訂し、ソーシャルメディアの投稿であっても「#ad」「#スポンサー」等の明確な開示が無いケースを取り締まる意向を示しました。
違反時のリスク管理
万一規制当局から警告書や是正通知を受けた場合は、15営業日以内など所定の期限内に原因究明と是正措置計画を文書で回答する必要があります。誠実かつ具体的な改善計画を示せば警告段階で収まるケースもありますが、対応が不十分だと差止命令のための司法措置や製品差押えに発展しかねません。
FDAも悪質な違反には連邦保安官による製品押収(2023年4月にも違法サプリ25万単位以上を一斉押収)や輸入差止め(Import Alertリスト掲載による通関拒否)等を行います。問題発生時に備え、日頃から製品の流通経路を把握(トレーサビリティ)し、必要に応じて速やかに回収できる体制を整備しておくことも重要です。
最近の違反事例から学ぶ教訓
違法成分混入とリコール
「Neptune’s Fix」事件(チアネプチン含有)では、FDA警告後に全国的な製品回収と販売停止が行われました。「Silintan」事件(NSAIDメロキシカム混入)では、FDA試験発表を受けメーカーが自主回収し、想定される心血管リスクによる訴訟や多額の賠償を回避する動きとなりました。
これらの例は、原料管理の不備や意図的な未承認成分使用が企業存続を危うくするリスクを浮き彫りにしています。業界では品質保証体制の見直しが進み、大手サプリメーカーの間では原材料サプライヤー認証プログラムや外部分析機関との提携強化など、違法成分の混入防止策への投資が拡大しています。
虚偽広告への制裁
関節サプリ事件では、FTCが科学的根拠のない効能広告に対して司法訴追に踏み切り、最終的に経営トップ個人にまで効能表示禁止命令を科しました。経営陣個人が責任を問われるケースは他にもあり、再犯企業の経営者が業界から追放される例も出ています。
罰金額についても、減量サプリをめぐる集団訴訟和解で数百万ドル以上の返金合意に至った例が報道されており、巨額の経済的損失やブランド毀損が現実のものとなっています。
大手販売チャネルへの波及
Amazonやドラッグストア大手への警告は、業界に衝撃を与えました。FDAが「販売者も違法製品流通の責任を共有する」との立場を明確化したことを受け、Amazonなどは出品審査を強化し、特定成分(SARMs、合成刺激薬、未承認医薬品成分など)の出品禁止リストを拡充する措置を取っています。
大手チャネルでの販売ハードルが上がる一方、悪質業者は自社ECサイトやSNS直販へ流れる傾向も指摘されており、当局はウェブ上の監視を強める方針です。正規業者にとっては、信頼性確保のための認証取得(NSFやUSPのサプリ認証など)が競争上ますます重要になっています。
まとめ:プロアクティブなコンプライアンス対策が鍵
2023~2024年にかけて進んだ米国サプリメント市場の規制強化策は、消費者保護と市場の信頼性向上を目的としたものです。業界には短期的な負担増となる面もありますが、中長期的には「玉石混交」状態から質の高い製品だけが残る健全な市場形成につながると期待されています。
企業側は、規制当局(FDA・FTC)の発信するガイダンスや警告事例を注視し、プロアクティブにコンプライアンス対策を講じることが肝要です。主要業界団体も規制当局との協調路線を取っており、消費者への教育キャンペーン展開やFDAの提唱する制度改革への建設的提言を行っています。
今後も、科学的エビデンスに基づく製品開発と適切な情報開示を徹底し、公的規制の動向に迅速に対応することが、米国市場で事業を行う企業にとって不可欠となるでしょう。規制強化の波を脅威ではなく、市場の健全化と自社の競争力強化の機会と捉える視点が求められています。
コメント