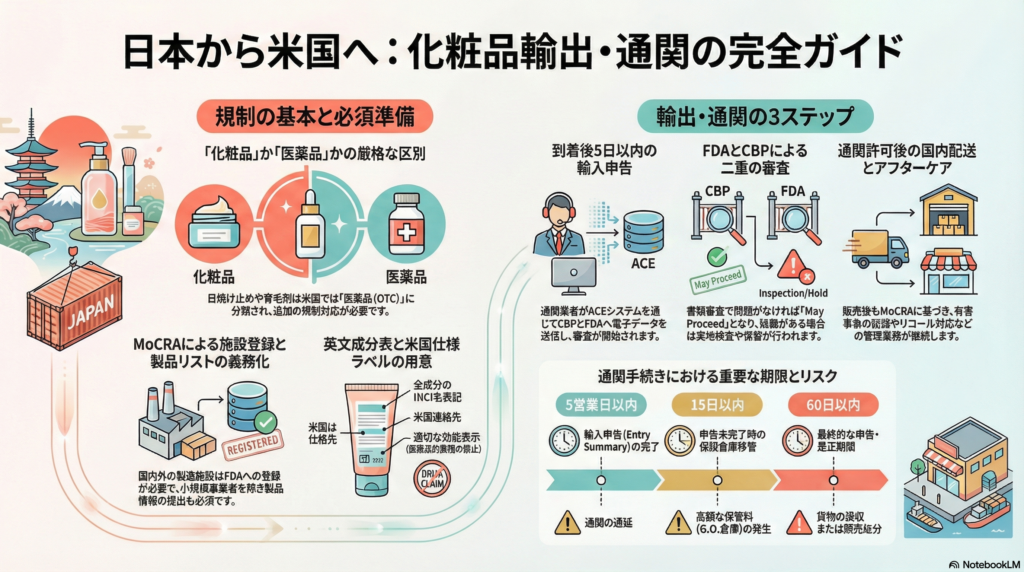
米国における化粧品の規制分類を理解する
日本から米国への化粧品輸出を成功させるには、まず米国における化粧品の規制上の位置づけを正確に把握することが不可欠です。米国食品医薬品局(FDA)では、化粧品を「人の身体に塗布して美化や清潔にする製品」と定義しており、医薬品的効果を謳わないものが化粧品として扱われます。
化粧品と医薬品の境界線
重要なのは、日本では化粧品として扱われている製品でも、米国では医薬品に分類される可能性があることです。特に日焼け止め(サンスクリーン)は米国では非処方医薬品(OTC)として規制されます。また、育毛、皮膚保護、シワの除去などの抗加齢効果、ニキビ・フケ・湿疹の治療といった人体の構造や機能に影響を与える効果を標榜する製品は、医薬品または医薬部外品とみなされます。
このため、輸出前に自社製品が米国法上「純粋な化粧品」に該当するのか、それとも医薬品的側面があるのかを確認することが重要です。医薬品に該当する場合、FDAによる事前承認やOTC医薬品モノグラフへの準拠など、追加の規制対応が必要になります。
違反時のリスク
米国に輸入される化粧品が有害な成分を含む、禁止された着色料を使用している、許容を超える微生物汚染がある、表示ラベルが不備である、医薬品的な効能を謳っているなど、米国の法律・規則に適合しないと判断された場合、その製品は不良品(adulterated)または表示違反品(misbranded)として米国への輸入を拒否される可能性があります。拒否された製品は、是正措置が取られない限り廃棄または税関から域外へ再輸出しなければなりません。
通関業者を利用した代理通関時に必要な書類
米国への化粧品輸出では、通関業者(Customs Broker)に依頼して輸入通関を行うのが一般的です。通関業者は提出された書類に基づき、米国税関への申告を代行します。
基本的な貿易書類
**商業送り状(Commercial Invoice)**は、荷送人(輸出者)と荷受人(輸入者)、商品明細(品名、数量、単価、総額)、貿易条件(インコタームズ)、原産国など取引の詳細を記載した送り状です。税関申告や課税の基本となる重要書類です。
**梱包明細書(Packing List)**は、出荷された貨物の梱包内容の内訳を示す書類で、各箱やパレットごとの品名・数量・重量・寸法などを記載します。検査時や受け取り時の照合に用いられます。
**船荷証券/航空運送状(B/L or AWB)**は、海上輸送なら船荷証券(Bill of Lading)、航空輸送なら航空貨物運送状(Air Waybill)を指します。運送契約と貨物の受渡し証となる書類で、貨物の輸送経路や運賃支払い条件等を示します。
輸入申告関連書類
通関業者は上記書類の情報をもとに**輸入申告書(Entry Summary)を作成します。また、米国税関に通関保証金(インポート・ボンド、CBP Form 301)**を差し入れる必要があります。通関保証は関税やペナルティ支払いを保証するもので、業者が単発もしくは継続ボンドを用意します。これら申告データ一式は貨物到着後5営業日以内にCBPへ提出しなければなりません。
化粧品特有の書類
**成分表(Ingredient List)**は化粧品の全成分の一覧表です。米国では成分表示が義務付けられているため、輸入者や当局から提示を求められる場合があります。FDAは輸入時に成分の適否(禁止成分の有無、着色料の許可状況など)を確認するため、英文の成分表を用意しておくことが推奨されます。
FDA登録情報として、2022年の法改正(MoCRA)により製造施設の登録番号および製品のリスティング情報を取得している場合、それらを通関業者に共有します。FDAの輸入審査では、任意提出の適合性コードとしてCOS(化粧品登録番号)を申告することが可能で、提供すればFDA審査の迅速化に役立ちます。
その他の必要書類
製品や取引条件に応じて、以下の書類も用意する場合があります。
**原産地証明書(Certificate of Origin)**は原産国を証明する書類で、関税の特恵待遇を申請する際などに要求されることがあります。
**自由販売証明書(Certificate of Free Sale)**は原産国で適法に販売されていることを示す証明書です。米国では必須ではありませんが、取引先から要求される場合があります。
**分析証明書(Certificate of Analysis)**は製品の成分や品質を分析した証明書で、FDAが特定成分の含有を懸念する場合や、過去に違反例がある製品(輸入アラート対象)では提出を求められることがあります。
製品ラベル見本は、輸入時にラベル表示内容の事前確認が必要な場合に備え、現物のラベルやその写真・データを用意します。
FDA事前通知(Prior Notice)と登録義務の実態
化粧品輸出において、しばしば混同されるのがFDA事前通知(Prior Notice)の要否です。
Prior Noticeは原則不要
Prior Noticeとは米国に食品を輸入する際、到着前にFDAへ事前に届け出る制度で、2002年制定のバイオテロ対策法に基づくものです。しかし、化粧品は食品ではないため原則としてPrior Notice提出義務はありません。この制度は人用・動物用の食品全般が対象であり、化粧品や医療機器等には適用されません。
ただし、リップバームや口腔用製品など食品的性質を持つ場合や化粧品原料が食品区分になる場合は例外的に関連法令(食品施設登録やPrior Notice)の対象となるケースがあります。通常の化粧品完成品については不要です。
MoCRAによる登録義務の導入
2022年12月に成立した「化粧品規制近代化法(MoCRA)」により、米国の化粧品規制は大きく変わりました。同法では米国内で流通する化粧品の製造施設登録および製品リストの提出が初めて義務化され、既存の事業者・製品については2024年7月1日までに登録・届け出を完了するよう求められました。
具体的には、米国向け化粧品を製造・加工する全ての国内外の施設はFDAに事業所登録(2年毎更新)し、製品ごとに製品リスティング(成分情報含む、年1回更新)を行う必要があります。小規模事業者(過去3年間の米国における平均売上高100万ドル未満)はこの義務の適用除外となる場合がありますが、目の粘膜に触れる製品、注射による製品、内服用、24時間以上作用が持続する製品などは売上に関係なく例外なく登録・リスト義務があります。
登録内容の詳細
海外メーカーであってもFDAへの施設登録が求められる点に注意が必要です。登録の際には米国代理人の選任や連絡先の提供が必要となり、製品リストには製造施設の登録番号、製品名、ブランド名、全成分リスト、製品ラベル画像、責任者(Responsible Person)情報など詳細を報告します。
Responsible Personとは製品ラベルに記載されるメーカー・包装業者・販売業者で、当該企業が責任を持ってFDA対応を行う主体です。これらの登録・リスト義務を怠ると法令違反となり、将来的に米国輸入差止めや罰則のリスクがあります。
税関(CBP)とFDAの連携プロセス
米国への化粧品輸入では、税関(CBP)とFDAが連携して審査を行います。
自動通関システムによるデータ連携
輸入者(または通関業者)は貨物の到着に際し、自動通関システム(Automated Commercial Environment – ACE)を通じて輸入申告データを電子送信します。申告データにはインボイス情報をもとにした品目の申告分類(HSコード)や貨物明細、貨物価額、輸入者・荷送人情報などに加え、FDA規制品の場合は製造者情報、製品のFDA製品コード、用途コード等が含まれます。
これらのデータは税関から自動的にFDAの輸入管理システムにも転送され、FDA側で化粧品規制に適合しているかレビューされます。入力データ中の製造業者名や輸入者名がFDAの内部データと照合され、また製品説明や任意提出の適合コードがチェックされます。
FDAによる審査と検査
税関から提供された情報に基づき、FDAは当該製品が禁止成分を含まないか、成分用途が適正か、必要に応じ認証済みの着色料を使用しているかなどを審査します。この際、FDAは違反の疑いに応じたインポートアラート(輸入警報)を参照し、過去に問題が指摘されたメーカーや製品の場合は厳格にチェックします。
審査システム上で問題がなければ「May Proceed(進行可)」として書類審査のみで自動的に通関許可となるケースもあります。一方、リスクが検知された場合や無作為検査の一環で、FDA担当官による貨物の実地検査やサンプル採取が行われることがあります。
検査が行われた場合、FDAは採取サンプルを分析し、成分や表示が米国規則に合致しているか調べます。問題がなければ「FDAリリース(FDA Released)」となり、FDAとして輸入を許可します。反対に問題が判明した場合は「留保(Detained)」の措置が取られ、是正がなされない限り最終的に入国拒否(Refused Entry)となります。
CBPによる最終許可
FDAの審査とは別に、税関(CBP)も通関書類の整合性や関税の納税、必要に応じ貨物検査を行います。税関検査では申告された品目分類や価格に誤りがないか、知的財産権侵害品でないか、輸入禁止品が混入していないか等を確認します。
これら税関側の手続も順調に進み、かつFDAから「問題なし」の通知が出れば、CBPは貨物の引き渡し(Release)を許可します。FDA規制品の場合、FDAの許可が下りるまでCBPは貨物を保留しますので、税関とFDAの双方のOKが出て初めて通関完了となります。
輸入通関の時系列ステップ
米国での輸入通関手続を流れに沿って整理すると、以下のようなステップになります。
ステップ1:事前準備(輸出前)
米国輸入規制に照らし、まず製品の適合性を確認します。具体的には、成分が米国で禁止・制限されていないか、製品の機能・広告表現が「医薬品」扱いになる恐れはないかをチェックします。あわせて製品ラベルを米国仕様(英語表示、内容量表示、成分表示、原産国表示、責任者連絡先表示など)に合わせておきます。
2024年以降は製造施設登録と製品リストをFDAに事前提出しておく必要があるため(MoCRA対応)、その登録番号や届け出内容も控えておきます。また、輸入者(米国内で通関を行う主体)を決め、通関業者との契約やインポートボンドの手配も済ませておきます。
ステップ2:出荷と書類作成(日本側)
製品の梱包・発送準備を行い、輸送手段(航空便・船便)の手配をします。輸出に際して商業送り状(インボイス)とパッキングリストを作成し、運送業者へ提出します。輸送書類としては船便ならB/L、航空便ならAWBが発行されます。
これら書類のコピー一式を米国側の通関業者へ事前に送付し、輸入申告の準備を依頼します。化粧品の場合、製品の成分表やラベル画像もあわせて業者に提供しておくと、申告時にFDA製品コードの選定や規制対応がスムーズになります。
ステップ3:貨物の到着と輸入申告(米国側)
貨物が米国の港湾・空港に到着したら、通関業者は税関に対し輸入申告(Entry)を正式提出します。通常、到着前から申告の準備は可能であり、貨物到着後5営業日以内に申告を完了する必要があります。
申告は電子的に行われ、前述のインボイス情報や貨物明細に基づき関税分類(HTSコード)と関税評価額を申告し、関税・税金の支払い(関税率は化粧品で0~6%程度が一般的)を手配します。同時に、FDAへ必要なデータ(製品コードや成分情報等)もシステム上送信されます。
輸入申告が貨物到着から15日以内に行われない場合、荷物はGeneral Order(G.O.)倉庫という保税保管施設に移管され、保管料が発生します。さらに到着後60日以内に申告がなされない場合、貨物は競売売却処分となるため厳重な時間管理が必要です。
ステップ4:FDAによる審査・検疫
税関への申告情報はリアルタイムでFDAにも共有されます。FDAは化粧品輸入品に対する審査を行い、提出情報に不備やリスクがないか確認します。多くの場合、電子データ照合のみで問題なければ即座にFDAから輸入許可(May Proceed)が出ます。
一方、FDAが詳細確認を必要と判断した場合、貨物は保留(FDA Hold)状態となり、FDA担当官が書類の追加提出(例えば成分安全性データや製造工程情報)を求めたり、現物検査・サンプル採取を実施します。
FDA検査の結果、違反が見つからなければFDAリリースとなり次のステップへ進みます。違反の疑いがある場合は「留置通知(Detention Notice)」が発行され、一定期間内に輸入者は異議申し立てや是正措置(廃棄または成分分析証明の提出など)を行う機会が与えられます。それでも問題が解決しない場合、該当製品は輸入拒否となります。
ステップ5:税関検査・通関許可
FDAの審査と並行して、税関当局も貨物や書類の検査を行います。輸入関税の納付が確認され、CBPによる物理的な貨物検査(必要な場合)が完了し、かつFDAからのリリース通知が得られれば、税関は正式に貨物の通関許可(Release)を出します。
万一、FDAから輸入保留・拒否の通知が出た場合、CBPは貨物の輸入を許可しません。その際、輸入者は貨物を国外へ送り返す(返品)か廃棄する選択を迫られます。
ステップ6:国内配送・販売
通関が完了し貨物を引き取った後は、米国内の倉庫への輸送や小売店への配送を行います。輸入者は引き続きFDAや他機関の規制に従って販売を管理します(例:有害事象の記録・報告義務やリコール対応など、MoCRAで強化されたアフターケア義務にも注意が必要です)。
化粧品輸出入における重要な注意点
最後に、日本から米国へ化粧品を輸出する際の注意点をまとめます。
製品分類の確認
輸出する製品が米国法上「化粧品」の範疇に収まっているか事前に確認してください。サンスクリーン(日焼け止め効果)や育毛剤、抗ニキビ剤などの要素があれば医薬品扱いとなり、事前にFDAの承認やOTC医薬品モノグラフ適合、施設登録(医薬品施設として)、製品の医薬品リスト(Drug Listing)など追加の手続が必要です。
医薬品に該当しながら化粧品として輸入しようとすると確実に問題視されますので、グレーな効能表示は避けましょう。また石鹸に該当する製品(主な洗浄作用成分がアルカリ塩で香料・着色料以外の添加物がない純粋な石鹸)は、FDAではなく消費者製品安全委員会(CPSC)の管轄となる点にも留意が必要です。
禁止・制限成分のチェック
米国で使用が禁止されている成分や使用に制限がある成分が配合されていないか確認します。FDA規則で明示的に禁止されている成分として、クロロホルム、塩化ビニル、水銀化合物など複数あります。例えば水銀は微量でも意図的な配合が禁止されており、検出されれば即座に違反です。
また紫外線防止剤(サンスクリーン成分)は前述の通り用途によって医薬品扱いとなるため配合制限があります。特に紫外線防止を目的として配合する場合はFDA承認済みの有効成分のみ使用可能ですが、例えば製品の変色防止など目的が化粧品機能内に留まる場合は使用自体は許容されます。
その他、着色料は米国で許可されたもののみ使用しなければなりませんし、石油由来タール色素など一部はFDAのロットごとの認証証明が必要です。輸入者として、製品の成分が米国の基準に適合しているかは重大な責任事項であり、該当成分がないか事前にチェックしておく必要があります。
製品ラベルの遵守
ラベル表示は英語で全項目記載されていることが必須です。表示すべき内容は製品名、内容量(オンスおよびSI単位)、成分一覧(INCI名を米国慣用名で併記)、使用方法や注意事項、製造販売元もしくは責任者の名称と住所(米国の連絡先)など多岐にわたります。
特に2023年末施行のMoCRAにより、製品ラベルには米国内で連絡が取れる担当者の住所・電話番号あるいはウェブサイトを記載し、消費者から健康被害などの報告を受け付けられるようにすることが義務化されました。また香料アレルゲンについても一定のものは表示が求められるよう改正されています。
表示違反(例:成分表示の欠落、誤った容量表示、虚偽・誇大な効能表示等)は輸入拒否の主要因となります。「FDA承認済み(FDA Approved)」といった表示は化粧品には許されない(誤解を招く表示)ため絶対に避けてください。
FDA登録・リスティングの遵法
MoCRAに基づき米国向け化粧品の製造施設登録および製品リスト提出は法律上の義務となりました。現時点(2024年以降)で米国へ輸出を継続するのであれば、該当する日本国内の工場もFDAへ登録を完了し、製品情報をリスト提出しておく必要があります。
輸入時の書類として要求されるものではありませんが、FDAが輸入時に内部データで照合する可能性もあり、未登録だと後々問題となる可能性があります。特に米国で大規模に販売する計画がある場合は、この法令遵守状況も輸入審査で注目されるポイントとなるでしょう。
通関手続きとスケジュール管理
貨物が米国に着いてから通関が完了するまで、時間管理と正確な手続きが求められます。通関業者には事前に必要書類をすべて渡し、到着後速やかに申告してもらうことが重要です。
前述の通り、15日以内に申告しないと保税倉庫行きとなり、保管費用が発生します。また、税関は貨物到着の通知を逐一行わないため、輸入者側で追跡し能動的に動く必要があります。
輸入申告後も、FDAやCBPから追加情報の要求(例えば「この成分について詳しく説明せよ」「ラベルの写真を送れ」等)がある場合は迅速に対応します。要求に対応せず放置すると貨物は留置されたままとなり、最悪60日後に没収処分となります。信頼できる通関業者と緊密に連絡を取り、問題発生時には専門家(通関士、FDAコンサルタント等)と協力して対応策を講じることが大切です。
まとめ
日本から米国への化粧品輸出は、FDAと税関(CBP)の二重の規制に対応する必要があり、製品分類の確認、必要書類の準備、MoCRAに基づく登録義務の履行、禁止成分や表示規制の遵守など、多岐にわたる注意点があります。
特にMoCRAの施行により、従来は任意だった施設登録と製品リスティングが義務化された点は大きな変更です。また、日焼け止めのように日本では化粧品でも米国では医薬品扱いになる製品があることや、水銀などの禁止成分、着色料の使用制限、ラベル表示の詳細なルールなど、米国特有の規制を理解することが不可欠です。
通関業者との緊密な連携、正確な書類準備、スケジュール管理を徹底し、最新のFDA規制動向を踏まえて万全の準備をすることで、スムーズかつ安全な通関・販売を実現できるでしょう。
コメント