はじめに:コロナ禍がもたらした米国化粧品規制の転換点
新型コロナウイルス感染症の世界的流行は、米国における化粧品規制の在り方を根本から見直す契機となりました。米国食品医薬品局(FDA)は2020年以降、パンデミック対応の一時的措置と並行して、1938年以来となる抜本的な法改革に着手しています。
特に2022年12月に成立した「化粧品規制近代化法(MoCRA)」は、米国化粧品業界に劇的な変化をもたらしました。本記事では、コロナ後の規制変更の全体像を整理し、日本企業が米国市場で事業を継続・拡大するために必要な対応策を明らかにします。
2020年以降の規制変更:緩和か強化か
化粧品規制近代化法(MoCRA)の成立とその意義
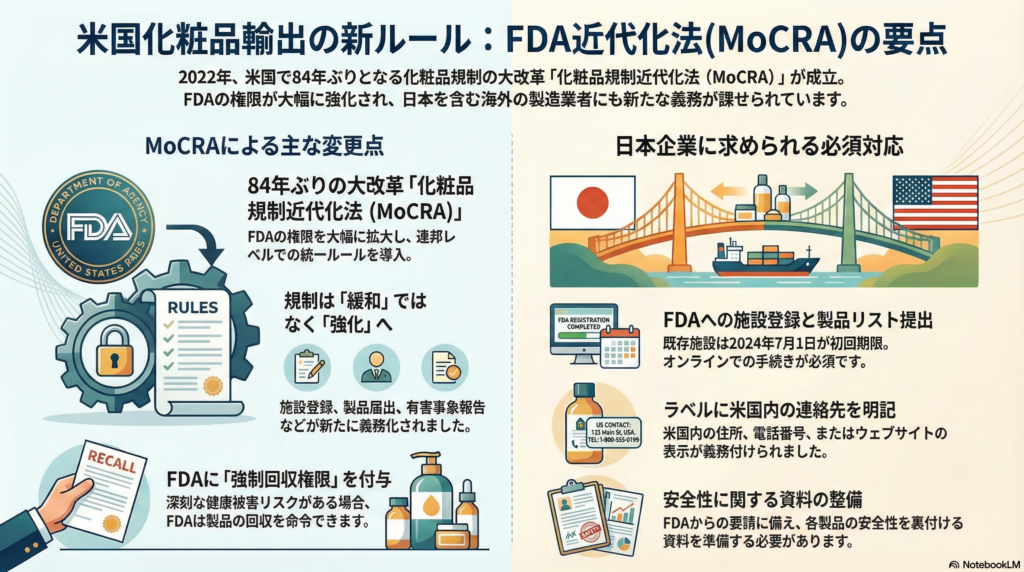
2022年12月29日に成立したMoCRAは、84年ぶりとなる米国化粧品法の大改革です。この法律により、FDAの権限は大幅に拡大され、化粧品製造施設の登録義務化や製品情報の届出義務化といった新たな要件が導入されました。
一見すると規制強化に見えるこの動きですが、実態はより複雑です。従来、米国では州ごとに異なる化粧品規制が存在し、企業は各州の要件を個別に満たす必要がありました。MoCRAによる連邦レベルでの統一ルール導入は、こうした規制のばらつきを緩和し、企業にとって予測可能性の高い事業環境を提供する側面も持っています。
COVID-19下の一時的緩和措置
パンデミック初期、FDAは医療用品や衛生用品の供給確保のために複数の一時的措置を講じました。最も注目されたのは、手指消毒剤の製造に関する規制緩和です。
通常は医薬品扱いとなるアルコール消毒剤について、FDAは非伝統的メーカーによる製造を一時的に認める方針を打ち出しました。この措置により、化粧品メーカーや酒造メーカーが製造ラインを転用し、2,000万ユニット以上の消毒剤が市場に供給されました。
ただし、これらはあくまで緊急時の例外的対応であり、平常時の化粧品規制そのものとは直接関係しない点に留意が必要です。
規制変更の具体的内容:日本企業が押さえるべき7つのポイント
1. 化粧品製造施設登録の義務化とオンライン化
MoCRA施行により、米国内で流通する化粧品を製造または加工する全ての施設は、FDAへの登録が義務付けられました。これには日本国内の製造施設も含まれます。
主な要件:
- 既存施設は2024年7月1日までに初回登録完了
- 2年ごとの更新義務
- 新規施設は製品初出荷から60日以内に登録
手続きはFDAが新設した電子ポータル「Cosmetics Direct」からの申請が推奨されています。オンライン化により、日本からでも効率的な手続きが可能になった点は、実質的な緩和要素と言えるでしょう。
2. 製品リスト提出義務と成分情報の開示
製品ごとのリスト提出も新たに義務化されました。責任者(製造業者、包装業者または販売元)は、米国市場で販売する各化粧品についてFDAに届出を行う必要があります。
提出が必要な情報:
- 製品名と用途
- 全成分リスト(香料や着香成分を含む)
- 製造施設の所在地
- 責任者の連絡先情報
当初2023年12月29日までの提出が求められていましたが、産業界からの要望を受け、FDAは2024年7月1日まで猶予する方針を示しています。新製品については販売開始後120日以内の提出が必要です。
3. ラベル表示要件の変更:米国内連絡先の必須化
MoCRAにより、製品ラベルに責任者の米国内連絡先を明記することが義務付けられました。消費者から苦情や有害事象報告を受け付けるための米国内の住所、電話番号、またはウェブサイトの表示が必要です。
日本企業が米国で製品を販売する場合、自社または代理人の米国住所・電話等をラベルに記載しなければなりません。表示不備は「misbranding」とみなされ、輸入差止めのリスクが高まります。
さらに、特定の香料アレルゲンの含有表示も義務化される予定です。具体的なリストは施行後18か月以内に提案される見込みで、欧州連合の規制に近づく動きとなっています。
4. 有害事象報告義務の新設
MoCRAにより、重大な有害事象の報告義務が化粧品業界にも導入されました。製品使用により入院や死亡、重篤な健康被害が発生した場合、責任者は当該事象を知ってから15営業日以内にFDAに報告する必要があります。
報告体制の要件:
- 初回報告は15営業日以内
- 新たな重要医療情報入手時は5営業日以内に追報告
- 有害事象報告関連の記録を6年間保存
- 製品ラベル情報の添付
これは規制強化ですが、適切な安全性管理体制を整えることで、製品回収リスクの低減や信頼性向上につながる可能性があります。
5. 強制回収権限の創設
FDAは初めて化粧品の強制回収を命令できる権限を得ました。深刻な健康被害のリスクがあるとFDAが判断した場合、公衆衛生上の緊急措置として発動されます。
日常的な輸入手続きに直接影響するものではありませんが、米国市場での製品安全に対する監督が強まった点は重要です。
6. 中小企業に対する適用除外
年間売上高が100万ドル未満の事業者には、施設登録および製品リスト提出義務を免除する規定があります。ただし、目の周りに使用する製品や注射・経口利用製品などリスクの高いカテゴリーは免除対象外です。
日本企業で米国市場への売上が小規模に留まる場合、この中小企業免除に該当する可能性がありますが、免除条件から外れる場合に備えた準備は必要です。
7. GMP(適正製造基準)の法制化
化粧品製造施設に対する適正製造基準(GMP)の遵守が義務化される予定です。国際標準であるISO 22716等に沿った基準が求められることになります。最終規則は現在策定中で、施行時期確定後に対応が必要となります。
日本企業が直面する実務上の課題と対応策
米国現地代理人の選任と体制整備
海外の製造施設もFDA登録義務の対象となるため、日本企業は米国における連絡窓口となる代理人を確保する必要があります。自社の現地法人、輸入代理店、または専門のコンサルタント会社を通じて、米国内住所・電話を持つ担当者を選任することが求められます。
製品ラベルにも米国内連絡先の表示が必須となったため、パッケージデザインや表示シールの見直しが不可欠です。日米での表示基準の違いに留意しつつ、早めにラベル修正を行うことが重要です。
製造所登録・製品届出の計画的実施
日本の工場で製造した製品を米国に輸出する場合、当該工場のFDA登録と製品ごとのリスト届出が必要です。必要情報として、製造所の基本情報や製品の成分一覧・カテゴリー等を英語で用意する必要があります。
初回登録・届出時には相当量のデータ収集と入力が発生するため、現地輸入代理店やコンサルタントと連携し、Cosmetics Directポータルを通じた電子申請手続きを計画的に進めることが求められます。2024年7月1日までに完了していないと、輸入時の通関拒否リスクがあります。
成分規制と安全性エビデンスの準備
米国の化粧品規制は欧州や日本に比べて禁止成分リストが限定的でしたが、MoCRA施行に伴い安全性に疑義のある成分への監視が強まると予想されます。
カリフォルニア州など一部州では既にホルムアルデヒドやPFASの使用禁止などの州法が施行されており、MoCRAによる連邦レベルの規制整備でこうした動きが全国一律化する可能性があります。
日本企業は自社製品の配合成分について最新の規制動向を注視し、必要に応じて処方変更や代替原料への切替を検討する必要があります。加えて、各製品について安全性を裏付ける資料を整備しておくことが重要です。
準備すべき安全性資料:
- 各成分の安全性試験結果
- 皮膚刺激性の有無に関するデータ
- 想定使用下での安全マージン評価
- 製品安全性の総合評価報告書
FDAから求められた際に速やかに提出できるよう、日本本社と現地法人で情報共有体制を築いておくことが推奨されます。
規制変更が日本企業にもたらす機会
規制の明確化による事業計画の立てやすさ
MoCRA施行前の米国化粧品市場では、連邦法による規制が限定的である一方、州法や地方条例が複雑に入り組んでいました。MoCRAによる統一ルールの導入は、企業にとって遵守すべき要件が明確化されることを意味します。
手続きのオンライン化も進み、日本からでも直接FDA登録や製品届出が可能になった点は、中小企業にとっても参入障壁の低下につながる可能性があります。
安全性重視の姿勢による信頼性向上
有害事象報告義務や安全性エビデンスの保持要件は、一見負担に見えますが、適切に対応することで消費者からの信頼獲得につながります。日本企業は従来から高い品質管理水準を維持してきた実績があり、これを米国市場でも証明する機会となるでしょう。
安全性データの整備やトレーサビリティの確保は、万一の製品トラブル時にも迅速な対応を可能にし、ブランド価値の保護に寄与します。
最新情報の入手と専門家の活用
信頼できる情報源の活用
米国化粧品規制は現在も進化を続けており、追加の細則やガイドラインが随時発表されています。日本企業が最新情報を把握するためには、以下の情報源を定期的に確認することが重要です。
主な情報源:
- FDA公式サイト(cosmetics関連ページ)
- 連邦官報(Federal Register)
- 米国パーソナルケア製品協議会(PCPC)
- 日本貿易振興機構(JETRO)の海外調査レポート
専門家との連携
規制対応には専門的知識が必要となるため、以下のような専門家との連携が有効です。
- 米国化粧品規制に精通したコンサルタント
- 米国内の法律事務所(規制法専門)
- 現地輸入代理店や販売パートナー
- 業界団体のセミナーや研修プログラム
特にMoCRAの詳細解釈や中小企業免除の適用判断など、複雑な事項については専門家のアドバイスを受けることが望ましいでしょう。
まとめ:新たな規制環境下での成功への道筋
COVID-19以降の米国化粧品規制は、「緩和」と「強化」が混在する複雑な様相を呈しています。MoCRAの成立により、むしろ規制要件は明確化・強化された面が大きいものの、手続きのオンライン化や連邦レベルでの統一ルール導入は、長期的には企業の事業運営を容易にする要素も含んでいます。
日本企業にとって最も重要なのは、新規則への適応とコンプライアンス体制の整備です。具体的には、FDAへの事前登録・届出の確実な実施、米国向け表示の見直し、安全性データの管理が成功の鍵となります。
2024年7月1日の期限を念頭に、計画的な対応を進めることで、日本企業は安全で魅力ある化粧品を米国市場へ円滑に提供し続けることができるでしょう。規制変更を脅威ではなく、グローバル市場での競争力強化の機会と捉える視点が求められています。
コメント