はじめに
マッサージ器具は一見すると単純な健康機器に思えますが、米国では医療機器としての厳格な規制対象となっています。特に治療効果を謳ったり、安全性に問題がある製品は、FDAによる摘発やリコールの対象となり、企業に深刻な影響を及ぼします。
本記事では、実際にFDAが介入したマッサージ器具の摘発事例を詳しく分析し、どのような違反がどのような措置につながったのかを明らかにします。これから米国市場への参入を考える企業や、既存製品の法規制対応を見直したい方にとって、重要な教訓となる内容です。
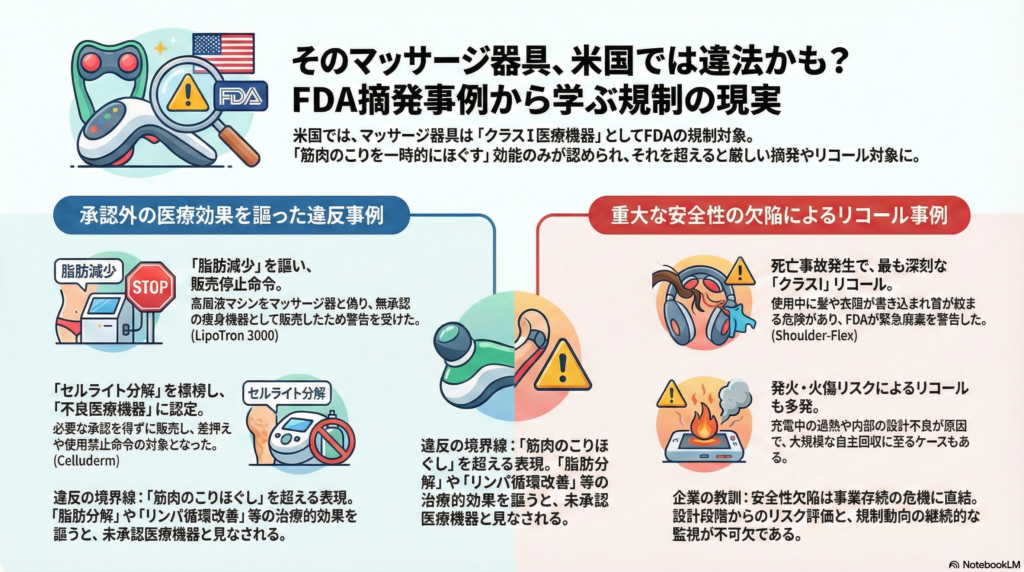
マッサージ器具に対するFDA規制の基本枠組み
クラスI医療機器としての分類
米国FDAは電気式マッサージ器具を21 CFR 890.5660に基づき医療機器として分類しています。これは「電動式で、軽度の筋肉痛の緩和など医療目的に用いられる機器」と定義され、リスクの低いクラスI医療機器に該当します。
通常、クラスI機器はプレマーケット承認や510(k)届出が免除されていますが、この免除には重要な条件があります。
適用除外の条件と限界
21 CFR 890.9に定められた適用除外の条件として、効能や用途が限定された範囲内であることが求められます。具体的には「疲労した筋肉の一時的なこりをほぐす」程度の表現にとどめるべきであり、治療的な効果を標榜することは認められていません。
この境界線を越えた瞬間、製品は未承認医療機器として摘発対象となります。以下で紹介する事例は、まさにこの線引きを誤った結果、FDAの厳しい措置を受けたケースです。
事例1:脂肪減少を謳ったRFマシン「LipoTron 3000」
製品概要と販売実態
LipoTron 3000はカリフォルニア州のRevecoMED社が開発した高周波マシンで、皮下に照射したRFエネルギーで脂肪細胞を加熱・破壊する仕組みの痩身機器でした。2007年頃から美容クリニックやメディカルスパに1台85,000ドル程度で販売され、「非侵襲で脂肪を溶解できる画期的技術」として宣伝されていました。
規制回避の試みと実態
RevecoMED社は当初FDAに510(k)届出を試みましたが失敗し、2011年には戦略を変更しました。本製品を「痛みの緩和に用いる電気マッサージ器」としてクラスIに再分類することで、FDAの事前承認なしに市場投入しようとしたのです。
しかし名目上はマッサージ器でも、実際には多くのクリニックで「脂肪除去」目的で使用・宣伝されており、実態は無承認の脂肪治療機器そのものでした。
FDAの対応と結果
FDAは2010年には本機の違法流通を把握していましたが、積極的な取り締まりは行っていませんでした。しかし2012年に内部告発者からの情報提供や公共市民団体からの申し立てによりメディアで大きく報じられると、状況が一変します。
2013年3月、FDAはRevecoMED社に警告書を発出し、FDA承認なしに脂肪燃焼用途で販売・宣伝する違法行為の停止を命じました。警告書により、メーカーには15日以内の是正措置報告が求められ、承認を得るまで販売中止が要求されました。
公共市民団体はこの措置を「適切だが数年遅すぎた」と指摘しています。市場では本機が長期間「事実上ブラックマーケット状態」で使用されていたことが問題視され、RevecoMED社はウェブサイト上の表現修正などの対応に追われました。
事例2:セルライト除去を謳った吸引マッサージ機「Celluderm」
製品の特徴と違反内容
CelludermはカナダのBody, Mind & Soul Inc.が米国で販売していた美容目的のマッサージ装置です。吸引によるボディマッサージ機能を備え、「セルライトの分解」や「リンパ循環の改善」を謳っていました。
本製品はFDAに510(k)届出やPMA承認を一切取得していませんでした。取扱説明書には「リンパ系を刺激して滞りを減らす」「脂肪の凝集を攻撃して分解する」等の医療効果が明記されており、これらの表現が脂肪減少や体内浄化といった治療的効能を標榜している点が問題視されました。
連邦法違反の指摘
2013年3月、FDAは製造元の米Innovative Med社に警告書を発行しました。警告書では、Celludermが未承認の新医療用途で流通しているため、医療機器法上の「不良医療機器」に該当し、また適切な届出なく市販されたことで「誤ブランド品」にも該当すると指摘されています。
具体的には、プレマーケット承認も治験許可もなく販売されたことによる連邦食品医薬品化粧品法第501条(f)(1)(B)違反、および510(k)未届出による第502条(o)違反が挙げられました。
法的措置の警告
FDAは同社に対し、必要な承認または届け出を行わない限り販売を停止するよう命じ、是正がなされない場合は差し押さえや使用禁止命令等の法的措置もあり得ると警告しました。
この措置により、当該製品は米国内で事実上販売不可となり、企業は広告内容の修正や承認取得検討を迫られました。本件はLipoTronケースと同時期に発生しており、FDAが治療効果を謳うマッサージ器具に対して監視を強化した時期の象徴的事例です。
事例3:死亡事故を起こした「ショルダー・フレックス」のリコール
製品の危険性
ショルダー・フレックスは肩や首筋に当てて使用する家庭用電動マッサージ器具で、深部指圧風の揉み玉によるマッサージ効果を謳った製品でした。米国各地の小売店や通販で2003年から2011年頃に販売されましたが、構造上の重大な欠陥が発覚します。
使用中に回転する揉み部にユーザーの髪の毛、衣服、ネックレスなどが巻き込まれる恐れがあり、最悪の場合首が絞まって死亡事故につながるリスクがありました。実際に1名の死亡事故と1件の首絞めによる瀕死事故が報告されています。
リコールの混乱とFDAの緊急対応
2011年8月31日、輸入販売元のKing International社は自主的にリコールを発表しましたが、同社はその後まもなく倒産し、リコール手続きが途中で頓挫してしまいます。販売店の多くもリコール情報を把握しておらず、購入者への通知が行き届かない状態でした。
そこでFDAは同年12月21日付で異例の緊急安全警告を発し、「ショルダー・フレックスを直ちに使用中止し廃棄するように」と消費者と医療関係者に向けて周知しました。具体的には、デバイスのマッサージ指部分を取り外して廃棄し、本体も他人が使えないよう廃棄するよう指示しています。
クラスIリコールの意味
FDAは本件をクラスI、つまり最も深刻な危害の恐れがあるリコールに分類し、監視を強化しました。この結果、市場からは当該製品が回収・排除され、新たな被害発生は防止されました。
ショルダー・フレックス事件は、マッサージ器具であっても安全性欠陥があればFDAにより厳しく規制・摘発される典型例となりました。
その他の規制措置:輸入警告とリコール事例
輸入警告による水際対策
海外製のマッサージ器具がFDAの認可なく医療効果を謳っている場合、輸入時に拘留されることがあります。FDAの輸入警告#89-08では、正規の510(k)届出なしに米国に出荷された美容・治療用途のマッサージ器が対象リストに挙げられています。
香港からの眼球マッサージャーやLED美顔マッサージ器具などが対象品目として追加された例があり、輸入警告リストに掲載された製品やメーカーの貨物は、FDA法令違反の疑いがあるものとして通関時に無検査留保され、輸入業者は適法性を証明しない限り米国内に流通させることができません。
発火・火傷リスクによるリコール
マッサージ器具の中には、安全性上の問題で発火・火傷等の危険が判明しリコールされるケースもあります。2020年には米Wahl社の充電式ヒートマッサージャーにおいて内部接続部の設計不良による過熱・発煙が報告され、火災の危険性があるとして自主回収が実施されました。
対象製品は「Wahl 4212 加熱式マッサージャー」で、充電中に過度に発熱し稀に発火のおそれがあることが判明したため、同社は全ロットについて販売店への通知と製品回収を行い、FDAも2021年2月にクラスIIリコールとして公表しています。
また大手メーカーHoMedics社も、赤外線加熱機能付き手持ちマッサージャーで類似の過熱・火傷事故が起きたため約8万7千台の大規模リコールを実施した例があります。
企業が学ぶべき教訓と対策
広告表現の重要性
これらの事例から明らかなのは、マッサージ器具の広告表現が規制違反の最大の引き金となっていることです。「脂肪減少」「セルライト分解」「リンパ系刺激」といった医療的効能を謳った瞬間、製品は未承認医療機器として扱われます。
「疲労した筋肉の一時的なこりをほぐす」程度の表現にとどめることが、クラスI免除を維持するための鍵となります。
製品安全性の徹底
ショルダー・フレックスの事例が示すように、安全性欠陥は企業の存続を脅かします。設計段階からリスクアセスメントを徹底し、巻き込み、過熱、発火などの潜在的危険を排除することが不可欠です。
規制環境の監視
FDAの規制姿勢は時期により変化します。LipoTronのケースでは、当初FDAは積極的な取り締まりを行っていませんでしたが、内部告発や市民団体の圧力により方針が変わりました。企業は常に規制動向を監視し、早期に対応する体制を整える必要があります。
まとめ
米国ではマッサージ器具であっても医療機器としての法規制を逃れることはできません。未承認の治療効果を謳えばFDAから警告書や差止め措置を受け、安全性に問題があればリコールや使用中止勧告の対象となります。
今回紹介した事例は、いずれもマッサージ器具が本来の範囲を超えた医療的主張や欠陥によりFDAに摘発されたケースです。企業にとってFDA規制遵守は単なる法的義務ではなく、事業継続のための必須要件といえます。
適切な広告表現の選択、徹底した製品安全設計、そして規制環境の継続的な監視。これらを実践することで、米国市場での長期的な成功が可能となるでしょう。
コメント