はじめに
米国市場への化粧品輸出を検討する日本の小規模ブランドにとって、2022年12月に成立したMoCRA(Modernization of Cosmetics Regulation Act)は無視できない規制変更となっています。1938年以来、実質的な改正が行われてこなかった米国の化粧品規制が現代化され、FDA(米食品医薬品局)に新たな権限が付与されました。本記事では、MoCRAの主要な規制内容と、日本の小規模化粧品ブランドが米国市場参入時に直面する具体的な影響について解説します。
MoCRAの成立背景と規制の目的
MoCRAは2022年12月29日に連邦歳出法の一部として成立し、2023年12月29日に主要条項が発効しました。この法改正は10年以上にわたる関係者間の協議を経て実現したもので、消費者が日常的に使用する化粧品の安全性を確保することが主な目的です。
従来、米国では化粧品に対する規制が他のFDA管轄製品(医薬品や食品など)と比較して緩やかでした。MoCRAの成立により、化粧品業界にも製品の安全確保と透明性向上のための新たな義務が課されることになり、安全性に関する科学的根拠に基づく規制強化が期待されています。
2023年~2024年の施行スケジュールと最新動向
MoCRAの施行に向けて、FDAは段階的に準備を進めてきました。2023年8月には化粧品施設登録および製品リスティングに関するドラフトガイダンスを発表し、業界から40件以上のコメントを受け付けました。その後、2023年12月18日にはFDAの電子申請ポータル「Cosmetics Direct」が稼働を開始し、オンラインでの施設登録や製品リスト提出が可能になっています。
ただし、業界への配慮として、FDAは施設登録および製品リスト提出の法定期限(2023年12月29日)から半年間は積極的な取り締まりを行わない方針を示しました。具体的には2024年7月1日までは遵守を強制しない旨のコンプライアンス方針が発出され、企業に追加の準備期間が与えられています。この猶予は法的義務の延期を意味するものではなく、FDAは企業に対し速やかな対応を奨励している点に留意が必要です。
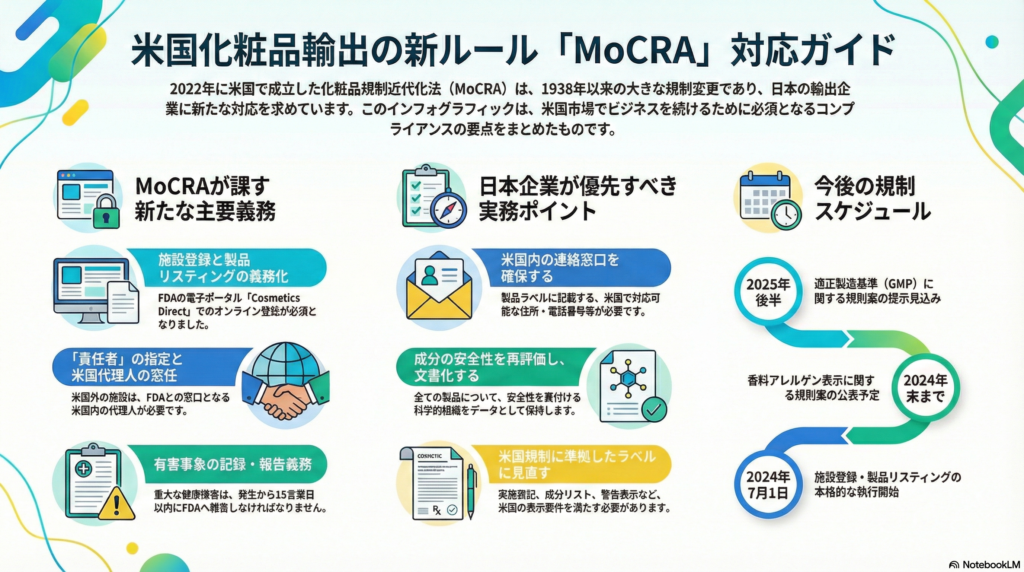
小規模ブランドに求められる主要な義務
施設登録と製品リスティング
MoCRAにより、米国で流通させる化粧品について製造施設のFDA登録(2年ごとの更新)と各製品のFDAへのリスト提出が義務化されました。以前は任意参加であった自発的化粧品登録プログラム(VCRP)が終了し、法的に必須の登録制度に移行した形です。
登録・リストには製品名、成分情報(香料や着色料を含む)、製造施設のFEI番号など詳細な情報が求められます。2022年末時点で製造販売中の製品は2023年末までにリスト提出が必要であり、その後発売する製品も初回出荷後120日以内にリスト登録を行う必要があります。小規模ブランドは自社製品のデータ管理と正確な申請作業が求められるため、社内体制の整備が不可欠です。
責任者(Responsible Person)の指定と米国代理人の選任
MoCRAでは「責任者(Responsible Person)」という概念が明文化され、各製品のラベルに記載された製造業者・包装業者・販売業者がその製品の法令遵守責任を負うと定義されています。責任者はFDAへの報告や製品リコール対応の窓口となり、重大な有害事象の報告義務などを担います。
日本から米国に製品を供給する場合、製品を製造する海外施設については米国内に所在する代理人(U.S. Agent)の選任が求められます。この代理人制度により、信頼できる現地代理人もしくは輸入販売業者の協力が不可欠となります。米国外の製造施設は米国在住の代理人(個人または企業)を指名し、FDAとの連絡や査察調整を代行させる必要があります。
アレルゲン(香料成分)の表示義務
MoCRAには香料由来アレルゲンの表示に関する新規定も盛り込まれており、消費者向けおよび専門家向け化粧品の成分表示ラベル上に、特定の香料アレルゲンを個別に記載することが義務化されます。
具体的な対象アレルゲンリストや濃度閾値等の詳細はFDAが規則策定中ですが、欧州連合(EU)で表示義務のある26物質などが参考にされる可能性があります。この要件はFDAが実施規則を策定した後に発効するため、2024年末までに規則案が公表される見通しです。小規模ブランドも自社製品の香料成分を精査し、該当するアレルゲン物質が含まれる場合は成分リストに明示する準備が必要です。
適正製造基準(GMP)への適合
従来、米国では化粧品に明確なGMP基準が存在しませんでしたが、MoCRAはFDAに対し化粧品GMP規則の策定を義務付けました。FDAはISO 22716(化粧品の国際GMP規格)に基づく基準策定を示唆しており、化粧品製造施設は衛生管理や品質管理について一定の要件遵守が必要となります。
小規模ブランドに対しては配慮措置があり、平均年間売上高が100万ドル未満(直近3年)の事業者はGMP要件および施設登録・製品リスト提出が原則免除される旨が規定されています。ただし、目や粘膜に接触する製品など一部カテゴリの製造者は適用除外とならないため、アイメイク製品を扱う場合は売上規模に関わらず免除対象外となる点に注意が必要です。
有害事象の記録・報告義務
MoCRA施行後は、化粧品による健康被害のアドバースイベント(有害事象)報告が法的義務となりました。重大な有害事象が発生した場合、各製品の責任者はその情報を15営業日以内にFDAへ報告する必要があります。
加えて、全ての有害事象について企業内で記録を6年間保存する義務も課されています(小規模事業者の場合は3年間に短縮)。報告には当該製品のラベル添付も求められ、報告後1年以内に新たな医学的情報が得られた場合は追加報告も必要です。小規模ブランドであってもこの報告義務から除外されることはないため、消費者からの苦情受付体制の整備や迅速な社内報告フローの構築が重要です。
日本企業が優先的に対応すべき実務ポイント
米国内の連絡窓口の確保
日本企業が米国で化粧品を販売する場合、米国に在地する責任者や代理人を確保することが最優先事項です。製品のラベルには米国法人または代理人の名称・所在地を表示し、消費者やFDAからの連絡を受け付けられるようにする必要があります。
現地法人の設立や、信頼できる輸入販売業者・コンサルタントとの契約によってFDA対応窓口を米国内に用意しておくことで、規制要件への対応がスムーズになります。
成分の再評価と安全性実証
自社製品の配合成分を改めて精査し、米国で禁止・制限されている物質が含まれていないか確認します。米国FDAは塩化メチレン、クロロホルム、特定の水銀化合物などを化粧品に使用できない成分としてリスト化しており、これらが配合されていれば代替成分への変更が必要です。
MoCRA施行により各製品について「安全性の適切な実証(Adequate Substantiation of Safety)」がメーカーの責務として明確化されました。日本企業も自社製品の安全性データ(毒性試験結果、既存文献、各成分の安全評価書など)を収集・整理し、安全性を裏付けるエビデンスを文書で備えておくことが求められます。
ラベル表示の見直し
米国向け製品のパッケージやラベルは、法定表示項目を英語で明記する必要があります。具体的には製品名/用途、正味量(内容量のオンス・グラム表示)、成分リスト(INCI名称使用)、製造販売業者名と住所、使用上の注意や必要な警告表示などが該当します。
MoCRAにより新たに消費者相談窓口の連絡先(住所・電話番号・電子メール等)の表示が義務化されており、ラベル上に米国内で機能する連絡先を記載しなければなりません。日本語表記のみのパッケージは認められないため、必要に応じて英語表記ラベルへの貼り替えやデュアルランゲージ表示を行い、米国の包装表示法(FPLA)や州法にも適合した表示内容に更新することが重要です。
GMP体制の早期準備
日本国内で製造した化粧品を米国に輸出する場合でも、製造拠点が国際的な化粧品GMP基準(ISO22716など)を満たしているか確認する必要があります。FDAはMoCRAに基づき化粧品GMP規則を策定中であり、2025年後半に規則案が提示される見通しです。
年商100万ドル未満の事業者にはGMP遵守猶予や適用除外が認められるものの、ビジネス拡大に伴い適用除外から外れる可能性もあります。日本企業は自社・委託先工場の製造プロセスを点検し、必要に応じて国際標準に沿った品質保証手順を導入するなど、早めのGMP準備を進めることが望まれます。
アフターケアと当局対応の体制構築
米国市場では、製品出荷後のトラブル対応や当局からの要請への迅速な対応も求められます。MoCRAによりFDAは企業記録の査察権限やリコール命令権限を付与されており、問題製品が発見された場合に文書提出要求や是正措置が行われる可能性があります。
日本企業は万一の際に備え、有害事象の社内報告フローや製品回収計画をあらかじめ策定しておくとともに、代理人や現地流通パートナーと協力して迅速に対応できる体制を構築しておくべきです。
今後の規制スケジュールと見通し
MoCRAの各種要件は2023年末以降順次施行され、今後1~3年の間に段階的に運用強化されていく見通しです。
2024年7月1日以降はFDAが施設登録・製品リスティング要件の本格的な執行に踏み切る予定であり、それまでに多くの企業が初回登録・届出を完了すると予想されます。2024年末までにはFDAが香料アレルゲン表示の具体的規則案を公表予定であり、どの物質をどの濃度以上含む場合に表示義務が課されるか明確になる見込みです。
2025年には適正製造基準(GMP)の規則案が後半(10月頃)に提示される見通しで、GMP規則は業界に与える影響が大きいため、ドラフト段階から注視が必要です。最終規則の公布後、企業規模に応じて段階的な適用猶予期間が設けられる可能性があります。
2026年以降はMoCRAに基づく全ての新規制が出揃い、本格施行段階に入ると見られます。FDAは2025年末にPFAS(有機フッ素化合物)に関する調査報告書を公表しており、この結果を踏まえてPFAS使用制限などの追加規制が議論される可能性もあります。
まとめ
MoCRAの成立により、米国化粧品市場における規制環境は大きく変化しています。日本の小規模化粧品ブランドが米国市場に参入する際には、施設登録・製品リスティング、責任者の指定、アレルゲン表示、GMP対応、有害事象報告など、多岐にわたる新規要件への対応が必要です。
特に小規模事業者には一部要件の適用除外が認められているものの、消費者安全に直結する義務は全事業者に課される点に留意が必要です。米国内の連絡窓口確保、成分の安全性実証、ラベル表示の見直しなど、優先的に取り組むべき実務ポイントを押さえ、段階的な規制施行スケジュールに先んじて準備を進めることが求められます。
常に最新のFDA発表やガイダンス文書を確認し、必要に応じて現地の法規制専門家との連携を図ることで、MoCRA時代の米国市場参入におけるコンプライアンス対応を円滑に進めることができるでしょう。
コメント